【研究背景】
睡眠占据我们生命的三分之一,并且仍然是最神秘的状态之一。睡眠与清醒之间的差异对人类健康至关重要,两者之间的紊乱转换伴随着脑疾病的出现。神经影像学研究的结果显示,在睡眠和清醒状态下发生着截然不同的神经行为,但需要进一步的研究来揭示它们的具体特征。
【研究方法】
1. 数据收集
利用公共颅内立体脑电图(stereo-EEG)数据集进行数据收集,可从网址 https://mni-open-ieegatlas.research.mcgill.ca/ 获取。这些数据记录了覆盖大范围脑区的神经振荡,提供了最高的时间分辨率。研究者选择了清醒状态和三个睡眠阶段的脑内立体-脑电图信号进行分析,包括快速眼动(REM)、非快速眼动第2阶段(N2)和非快速眼动第3阶段(N3)。
2. 被试情况
总共有91名癫痫患者参与了研究,所有患者都签署了知情同意书;本研究采用了其中不到十个的患者数据。
3. 数据预处理
对颅内立体脑电图(stereo-EEG)数据进行预处理,包括去噪、滤波等步骤,以确保数据的质量和可靠性。
4. 频谱分析
将脑电信号分为不同的频带振荡,包括亚慢速(0.1–1 Hz)、δ波(1–4 Hz)、θ波(4–8 Hz)、α波(8–13 Hz)、β波(13–30 Hz)和γ波(30–45 Hz),以便进行后续分析。
5. 神经科学角度的系统性分析
研究者从系统神经科学的角度来分析大脑活动,并使用网络表示来描述神经元群体之间的相互作用。图论被用作理论架构,并分别强调了结构连接和功能连接的重要性。研究者特别关注神经振荡的信息流,并将网络控制检测引入研究,以探索大脑网络的全局动态导航。
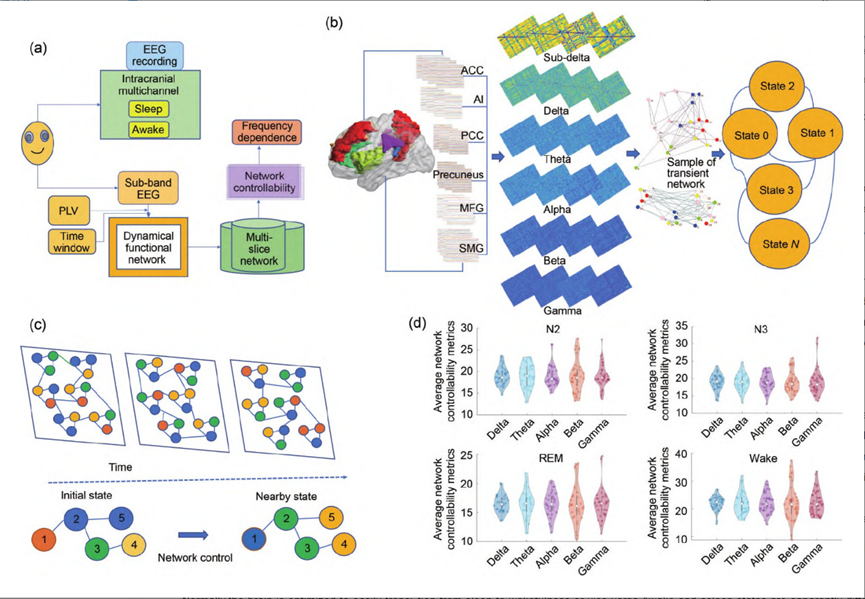
图1. 流程框架示意图。 (a) 涉及的技术; (b) 清醒和睡眠条件下的大空间时变网络状态; (c) 网络控制的示意图; (d) 楔前叶区域在清醒和睡眠条件下平均网络可控性指标的小提琴图。EEG: 脑电图; PLV: 相位锁定值; REM: 快速眼动; N2: 非快速眼动2阶段; N3: 非快速眼动3阶段; ACC: 前扣带皮层; AI: 前岛叶; PCC: 后扣带皮层; MFG: 中央额回; SMG: 上边沿回。
6. 动态功能连接提取
利用相位锁定值(PLV)和非重叠滑动时间窗口从时间窗口化的脑电神经振荡中提取动态功能连接,以捕捉不同频带振荡之间的相互关系。
7. 空间水平评估
研究者对对网络可控性进行评估时采用了三个空间层次:在小空间网络,研究考虑了单个脑区,包括前岛叶(AI)、前扣带皮质(ACC)、中央额回(MFG)、上边沿回(SMG)、后扣带皮质(PCC)和楔前叶(precuneus)等。在中等空间网络,对三个主要网络进行了评估,包括显著性网络(SN)、前额-顶叶网络(FPN)和默认模式网络(DMN)。在大空间网络,将SN、FPN和DMN组合成最大的空间网络(SNFPN-DMN网络)。
8. 网络可控性分析
针对时变脑网络,实施平均和模态网络可控性分析,以量化网络的控制性能。
平均网络可控性(Average Network Controllability): 这一指标衡量了整个网络在平均水平上的可控性,即网络中节点的平均可控性。研究者采用了网络控制理论中的方法来计算平均网络可控性,这使我们能够了解整个网络在不同条件下的控制性能。
模态网络可控性(Modal Network Controllability): 与平均网络可控性不同,模态网络可控性更侧重于网络中难以控制的节点或区域。这一指标可以帮助我们理解在特定条件下,网络中哪些区域对于控制网络的整体动态具有关键作用。研究者通过将不同频率带的脑电信号进行分析,结合网络控制理论中的模态可控性计算方法,来评估模态网络可控性。
9. 统计分析
在本研究中,采用了多种统计方法来分析动态功能连接网络的数据,并确定频率成分和脑区对网络可控性的影响。
首先,对于频率成分的分析,采用了方差分析(ANOVA)来比较不同频率成分在网络可控性上的差异。ANOVA可以帮助确定哪些频率成分对大脑网络的动态特性具有显著影响。
其次,针对脑区的分析,同样使用了ANOVA来比较不同脑区(例如AI、ACC、MFG等)在网络可控性上的差异。这有助于确定不同脑区在整体网络动态中的特定作用。两个分析的显著性水平都设定为 p < 0.001。
为了控制多重比较的问题,采用了误差发现率(FDR)进行校正,以确保发现的差异具有统计显著性,并降低误报率。
最后,利用所获得的统计结果,对不同频率成分和脑区的影响进行了综合分析,以揭示大脑网络动态连接的特征和机制。
【实验结果】
1. 脑电信号分析及网络可控性
1)脑电信号分析
研究者使用脑电信号分析来评估大脑网络的可控性,包括平均可控性和模态可控性度量。研究者将脑电信号分为六个亚带,特别关注亚慢速带(0.1–1 Hz)振荡,因为它们在非快速眼动第3阶段(N3)睡眠中起着关键作用。并通过瞬时相位锁定的强度来代表脑网络中的邻接元素。结果显示了在不同睡眠状态下脑区间的显著差异,尤其是在中等空间网络水平和大的空间网络中的频率依赖性可控性方面。
中等空间网络的差异: 在中等空间网络水平上,研究者发现了与睡眠状态相关的特定网络活动模式,这些模式在清醒状态下并不明显或完全不同。这表明了大脑在不同睡眠状态下对网络活动的调节方式存在显著变化。
大空间网络的差异: 在大的空间网络中,研究者观察到了与睡眠状态相关的网络可控性变化。这些变化可能反映了大脑在睡眠和清醒状态之间转换时对于信息处理和控制机制的调整。
频率带振荡的差异: 在亚慢速带(0.1–1 Hz)振荡方面,睡眠状态和清醒状态之间存在明显的频率依赖性差异。睡眠状态下的亚慢速带振荡可能与大脑的深度休眠阶段相关,而清醒状态下的这种振荡则可能与大脑的高度活跃性相关。
2)网络可控性的方差(ANOVA)分析
这部分基于对脑电信号的处理和分析,以及对网络可控性的量化评估(详见表S1至表S3)。
基于模态可控性度量,目标区域的所有六个频率分量之间存在显著差异(p<0.001)。PCC和楔前叶在不同条件下展示了频率相关变化,涵盖了所有四种不同条件。在AI中,睡眠条件下出现了显著差异,但清醒条件下未出现。(见表S1)
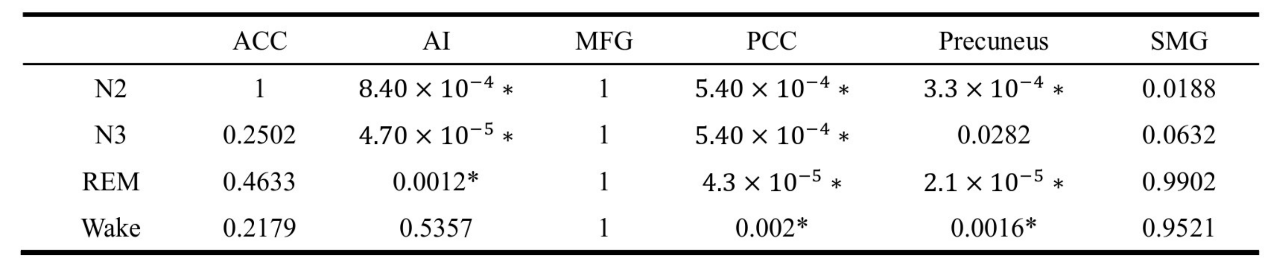
表S1 EEG网络中模态可控性的ANOVA检验
ANOVA:方差分析;N2:非快速眼动睡眠第2阶段;N3:非快速眼动睡眠第3阶段; REM:快速眼动;ACC:前扣带回皮质;AI:前纹状岛;MFG:中央额回;PCC:后扣带回皮质;SMG:上边缘回。
另外,通过计算平均可控性和模态可控性之间的相关性,并进行方差分析(ANOVA)测试(见表S2),发现从六个亚带频率成分派生的网络在模态和平均可控性度量方面存在显著差异。具体而言,ACC、AI、MFG和PCC在清醒条件下显示出特别显著的差异。

表S2:模态可控性与平均可控性之间的相关性的ANOVA检验
ANOVA:方差分析;N2:非快速眼动睡眠第2阶段;N3:非快速眼动睡眠第3阶段; REM:快速眼动;ACC:前扣带回皮质;AI:前纹状岛;MFG:中央额回;PCC:后扣带回皮质;SMG:上边缘回。
在表S3中呈现的四种条件下,几乎所有六个脑区都出现了显著差异。在几种条件下发现了例外情况: MFG在N2(p=0.0821)或REM(p=0.3076)条件下未显示显著差异,而且在REM条件SMG(p=0.0211)和楔前叶(p=0.0022)以及清醒状态下的AI也未显示显著差异。
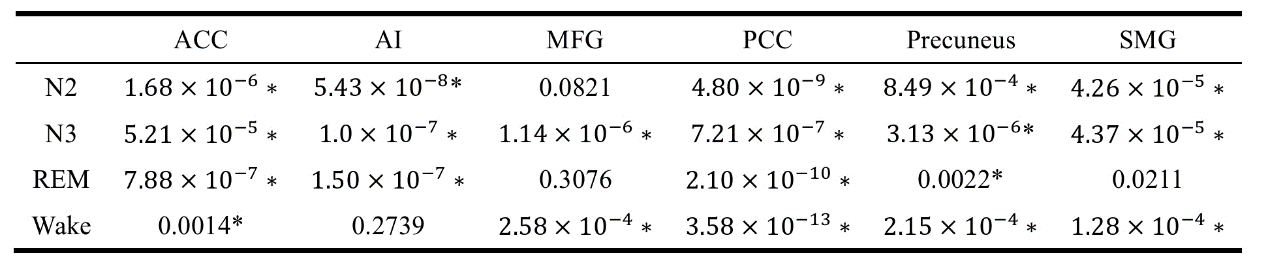
表S3:五个子频带 EEG 网络中平均可控性度量的ANOVA检验
ANOVA:方差分析;N2:非快速眼动睡眠第2阶段;N3:非快速眼动睡眠第3阶段; REM:快速眼动;ACC:前扣带回皮质;AI:前纹状岛;MFG:中央额回;PCC:后扣带回皮质;SMG:上边缘回。
【研究结论】
大脑在睡眠和清醒状态之间有明显的差异,这种差异在一定程度上反映了大脑功能的障碍。研究发现,通过频率依赖的网络可控性可以作为区分这两种状态的生物标志,揭示了从清醒到睡眠的转换基础。模态可控性和平均可控性在处理不同任务时发挥不同的作用,前者处理困难任务,后者处理简单任务。具体脑区在不同状态下显示出显著差异,如PCC在所有四种状态下都表现出频率相关变化,而AI在睡眠状态下也有显著变化。研究采用颅内立体脑电图和网络可控性揭示了清醒和睡眠之间的差异,为理解大脑频率成分的作用提供了新视角。这些发现对于未来临床电神经调控和更深入的大脑网络控制研究具有重要意义,但由于参与者数量有限,未来需要进一步研究来解锁这一领域的更多谜团。
【文献信息】
原文:Network controllability analysis of awake and asleep conditions in the brain
作者:Yan HE, Zhiqiang YAN, Wenjia ZHANG, Jie DONG, Hao YAN
期刊:Journal of Zhejiang University-Science B (Biomedicine & Biotechnology)
发表时间:2023.05.03
DOI: https://doi.org/10.1631/jzus.B2200393